Estequiometria Sem Mistério : Aula
- Maisquequimica
- 11 de nov. de 2021
- 2 min de leitura
Neste post falaremos sobre a tão temida Estequiometria, que na prática nao deveria dar tanto medo assim, afinal ela não passa de um estudo de relações. Começaremos por sua definição, Estequiometria é o estudo da quantidade de reagentes e produtos em uma reação química, é uma análise quantitativa de um fenômeno químico. Para estuda-la precisamos de alguns conceitos que servirá de base para este estudo: Massa Atômica, Mol, Massa Molar, Fórmula Química, Reação Química e Equação Química .
Massa Atômica/ Massa Molecular
A Massa Atômica é a massa de um átomo medida em Unidade de Nassa Atômica ( U ou U.M.A), ela é calculada com referência de 1/12 da massa do Carbono 12 , 1,66x10^-24 g equivale a 1U.
A massa molecular é a massa da molécula, também utiliza a Unidade de Massa Atômica como unidade de medida, a diferença é que é quando a Massa Atômica se preocupar com a massa de um átomo, a massa molecular considera a massa da molécula toda, por exemplo H2 = 2 x 1U = 2U , H2O = ( 2 x 1) + 16 U ( a massa do Hidrogênio mais a massa do Oxigênio) fornecendo o valor da massa da molécula toda. Esses números é encontrado na Tabela Periódica.
Massa Molar
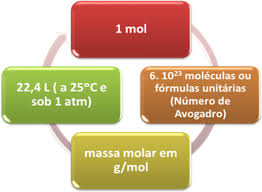
É a massa em gramas por um mol de matéria. Essa informação encontra-se na Tabela Periódica, ela é o número maior que está junto ao elemento, com excessão do Hidrogênio que o número atômico é 1u e a massa Molar é 1g. Essa informação quer dizer que em 1g de Hidrogênio possui uma quantidade de matéria igual a 1 mol, a massa Molar do oxigênio é 15,99g e dentro dessa gramatura há 1 mol de matéria. Sua unidade de medida é a g/mol ou g.mol^-¹.
Mol
É uma unidade de medida, assim como a dúzia, que são 12, por exemplo. O número que representa o mol é 6x10^23 unidades, conhecido como Número de Avogadro, essa é a quantidade de matéria presente na massa de um elemento qualquer possui, o hidrogênio por exemplo possui massa atômica 1g ( que equivale a 1u ), então 1g de hidrogênio possui 6x10^23 unidades de matéria. O oxigênio possui 16g de massa, então em 16g possui 6x10^23 unidades de matéria. A unidade de medida que utilizamos é a g/mol (gramas por mol)
Fórmula Química
É a fórmula mínima ou empírica, é a menor representação de um composto, como os exemplos da tabela a seguir :

Reação Química
É o processo pelo qual uma ou mais substâncias se transformam em uma ou mais novas substâncias, geralmente conseguimos ver essas reações, como a oxidação de um parafuso ou a decomposição de um alimento.

Equação Química
As equações químicas é a representação gráfica das reações, ela informa os aspectos qualitativos e quantitativos de uma reação química como o exemplo da oxidação do ferro abaixo:
4 Fe + 3 O2 -> 2 Fe2O2
Por enquanto é isso, mas nós próximos posts estudaremos outros conceitos importantíssimos para o bom entendimento da Estequiometria, vamos juntos derrubar essa barreira que nós impede de amar a química.



Comentários